Consultoria especializada em registros de produtos médicos no FDA e Europa.
Apoio completo para sua conformidade regulatória na saúde.
Consultoria regulatória
Consultoria em registros de produtos médicos de todas as classes de risco, UDI e sistema da qualidade


FDA
Oferecemos um portfólio completo de serviços de conformidade, projetado para cobrir todas as etapas da sua jornada regulatória.
Agente Americano (U.S. Agent)
Como uma empresa localizada nos EUA, a BHP Consulting LLC atua como sua representante oficial obrigatória perante o FDA. Este serviço é a base para empresas estrangeiras que desejam comercializar nos Estados Unidos.
Representação Oficial: Atuamos como seu ponto de contato principal para todas as comunicações, consultas e notificações do FDA.
Gerenciamento de Comunicações: Recebemos e retransmitimos informações oficiais, garantindo que você nunca perca prazos ou atualizações críticas.
Suporte a Inspeções: Facilitamos o agendamento e a coordenação de inspeções do FDA em suas instalações no exterior, quando aplicável.
Dispositivos Médicos
Somos especialistas em guiar fabricantes de dispositivos médicos através do rigoroso processo de liberação do FDA.
Registro de Estabelecimento e Listagem de Dispositivos:
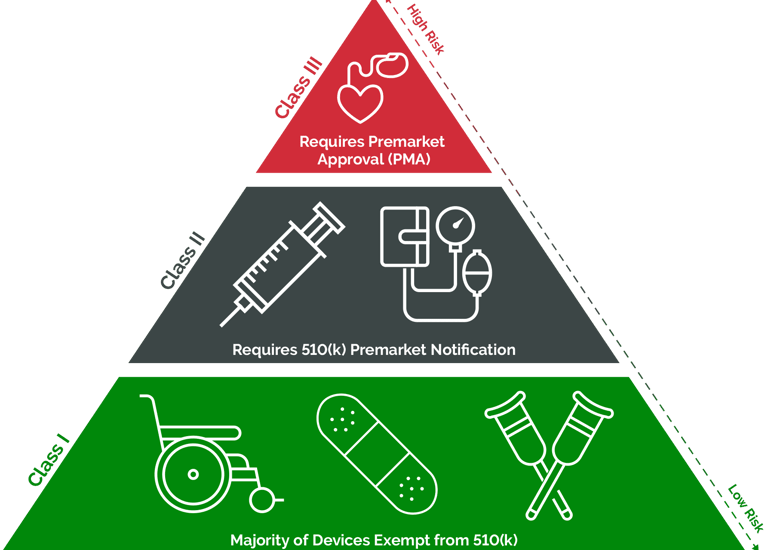
Análise e determinação da classificação correta do seu dispositivo (Classe I, II ou III).
Condução do registro inicial do seu estabelecimento (Establishment Registration) e listagem (Device Listing) de todos os seus produtos.
Gerenciamento do pagamento da taxa anual obrigatória do FDA.
Submissão Pré-Mercado 510(k):
Avaliação estratégica e análise de lacunas (Gap Analysis) da sua documentação técnica.
Preparação e compilação de dossiês 510(k) robustos, incluindo o formato eletrônico (eSTAR).
Submissão e gerenciamento completo do processo, atuando como seu representante direto para responder a solicitações de informações adicionais (AI Requests) do FDA.
Conformidade UDI (Unique Device Identification):
Orientação completa sobre os requisitos de rotulagem UDI.
Estruturação e submissão dos dados do seu dispositivo ao banco de dados GUDID (Global UDI Database) do FDA.
Registro de Instalações Alimentícias
Garantimos que suas instalações de alimentos e bebidas estejam em total conformidade para exportação aos EUA.
Registro de Estabelecimento: Conduzimos o registro inicial e a renovação bienal obrigatória de instalações que fabricam, processam, embalam ou armazenam alimentos.
U.S. Agent para Alimentos: Cumprimos o requisito de U.S. Agent específico para o registro de instalações alimentícias estrangeiras.
Registro de Cosméticos (Conformidade MoCRA)
Com a implementação do "Modernization of Cosmetics Regulation Act" (MoCRA), as regras para cosméticos mudaram. Nós garantimos sua adaptação.
Registro de Estabelecimento: Realizamos o registro obrigatório de suas instalações de fabricação de cosméticos no novo portal Cosmetics Direct.
Listagem de Produtos: Gerenciamos a listagem de seus produtos cosméticos, incluindo ingredientes e informações de fabricação, conforme exigido pelo MoCRA.
Suporte de Dossiê: Oferecemos orientação na compilação do Dossiê de Informações do Produto para substanciar a segurança dos seus produtos.

MDR 745/2017
Gerenciamento de Riscos (ISO 14971)
O MDR exige que o gerenciamento de riscos seja um processo vivo e integrado a todo o ciclo de vida do produto. Ele é a fundação da sua Ficha Técnica.
Implementação Robusta: Desenvolvemos e implementamos processos de gerenciamento de riscos em total conformidade com a ISO 14971 e os requisitos do MDR.
Análise e Mitigação: Conduzimos Análises de Risco (como FMEA) para identificar perigos, avaliar riscos e definir medidas de controle eficazes.
Documentação Completa: Elaboramos o Plano de Gerenciamento de Riscos, a Análise de Riscos e o Relatório final, garantindo que os riscos residuais sejam clinicamente aceitáveis.
Avaliação Clínica (MDR Art. 61 & MEDDEV 2.7/1)
A Avaliação Clínica (Clinical Evaluation) é o coração do MDR. A régua para "dados clínicos suficientes" subiu drasticamente. Nós ajudamos você a comprovar a segurança e o desempenho do seu dispositivo.
Planejamento Estratégico: Elaboração do Plano de Avaliação Clínica (CEP) alinhado com as alegações do seu dispositivo.
Revisão de Literatura Sistemática: Condução de buscas e análises de literatura rigorosas para identificar dados clínicos relevantes (state-of-the-art) e dados de equivalência.
Relatório de Avaliação Clínica (CER): Redação do Relatório de Avaliação Clínica (CER) completo, analisando e avaliando todos os dados (de literatura, testes pré-clínicos e investigações clínicas) para demonstrar conformidade.
Acompanhamento Pós-Mercado (PMCF): Desenvolvemos seus planos de Acompanhamento Clínico Pós-Mercado (PMCF) para garantir a coleta contínua de dados após a aprovação.
Plano de Avaliação Biológica (ISO 10993-1)
O MDR exige uma avaliação de biocompatibilidade, não apenas uma lista de testes. Nós adotamos uma abordagem baseada em risco para otimizar custos e tempo.
Estratégia de Avaliação: Elaboração do Plano de Avaliação Biológica (BEP), identificando os endpoints biológicos relevantes com base no contato com o paciente e na ISO 10993-1.
Análise de Lacunas (Gap Analysis): Avaliamos seus testes existentes e dados de materiais para identificar lacunas e evitar testes desnecessários.
Relatório de Avaliação (BER): Compilamos o Relatório de Avaliação Biológica (BER) final, justificando a segurança biológica do seu dispositivo com base em dados químicos, de literatura e testes.
Engenharia de Usabilidade (IEC 62366-1)
Um dispositivo seguro é um dispositivo que pode ser usado com segurança. O MDR coloca forte ênfase na Usabilidade como um componente crítico do controle de riscos.
Integração ao Design: Integramos a Engenharia de Usabilidade (ou Fatores Humanos) ao seu processo de desenvolvimento de produto.
Arquivo de Usabilidade: Criamos o Arquivo de Engenharia de Usabilidade (Usability Engineering File) completo, documentando todas as etapas do processo.
Planejamento e Validação: Desenvolvemos planos de testes de usabilidade (formativos e somativos) e analisamos os resultados para identificar e mitigar riscos relacionados ao uso.
US Agent
Temos escritório nos Estados Unidos para servir como contato para o FDA para a sua empresa!
Consultoria
Especialistas em registros de produtos médicos.
Entre em contato!
usagent@bhpconsulting.net
+55 14 98122-9294
© 2024. All rights reserved.
+1 (307) 650-2029
